- Los bioelementos, el agua y las sales minerales (añadiendo un apartado de enlaces que es interesante repasar de años anteriores y que el libro no incluye)
- Los glúcidos
- Los lípidos
- Las proteínas
- Los ácidos nucleicos
- La célula: unidad estructural y funcional. El núcleo.
Además de todos los apuntes necesarios para adquirir todos los contenidos para la prueba de acceso a la universidad, incluiré en esta misma entrada algunas de las preguntas de cada uno de los exámenes que hemos realizado (en nuestro caso, un examen que incluye los tres primeros temas, un segundo con el temario restante y un examen global a nivel de recuperación o subida de nota).
¡Comenzamos!
Tema 1: Los
bioelementos, el agua y las sales minerales
Conceptos
-
Elementos
simples: Sustancias que no se pueden separar por reacciones químicas ni por
procesos físicos y están constituidos por un solo tipo de átomos.
-
Átomo:
Parte más pequeña que forma un elemento simple. El átomo está formado por un
núcleo donde están los protones y neutrones y por una corteza donde están los
electrones.
- Molécula:
Unión de dos o más átomos. Si los átomos son del mismo elemento es una molécula
homogénea (O2 ); si está formada por
átomos de diferentes elementos se trata de una molécula heterogénea (H2O).
); si está formada por
átomos de diferentes elementos se trata de una molécula heterogénea (H2O).
 ); si está formada por
átomos de diferentes elementos se trata de una molécula heterogénea (H2O).
); si está formada por
átomos de diferentes elementos se trata de una molécula heterogénea (H2O).
-
Sustancia
compuesta: Es la sustancia que está formada por dos o más elementos
químicos que se pueden separar por reacciones químicas (NaCl). Su parte más
pequeña es una molécula heterogénea.
-
Enlace
químico: Unión entre átomos, moléculas… Tipos:
o
Enlace
iónico: Unión entre átomos en la que uno de ellos capta electrones del
otro. Se generan así aniones y cationes que quedan unidos por
atracción eléctrica. Los átomos tienden a completar con ocho electrones su
último orbital. Unos átomos captan electrones y por tanto, son elementos
electronegativos; mientras que otros átomos tienden a perder electrones de su
última capa y son elementos electropositivos. El enlace iónico se da siempre
entre un átomo muy electronegativo y otro muy electropositivo.
o
Enlace
covalente: Se da entre átomos que comparten electrones. Cada par de
electrones compartidos forman un enlace. Se dan entre átomos de
electronegatividad elevada y es un enlace muy fuerte.
§
Si los átomos tienen electronegatividad similar,
dan lugar a moléculas apolares, sin carga eléctrica. EJ: O2, butano…
§
Si unos átomos atraen más hacia sí los
electrones se forman moléculas polares, un polo positivo y uno negativo,
es decir, moléculas dipolares. EJ: H2O.
o
Enlace de
hidrógeno: Es específico de los átomos de hidrógeno (también conocido como
puentes de hidrógeno). Es muy débil. Se establece cuando átomos de hidrógeno se
unen a elementos muy electronegativos como el oxígeno, nitrógeno y fósforo. Se
debe a que el electrón del hidrógeno se ve atraído por el núcleo del elemento
electronegativo. Debido a ello el protón del núcleo muestra un carácter muy
positivo y atrae hacia sí los electrones de los átomos próximos.
o
Fuerzas
de van der Waals: Se da entre moléculas apolares o entre grupos apolares de
una misma molécula, debido a las atracciones electroestáticas que se originan a
causa de la distribución electrónica por azar. Se vuelve asimétrica durante
algunos momentos. Así surgen los dipolos instantáneos que llegan a inducir a
otros polos.
1- Los Bioelementos
Bioelementos o
elementos biogénicos: Elementos químicos que constituyen la materia viva.
·
Bioelementos primarios: Forman las
biomoléculas orgánicas.
·
Bioelementos secundarios: En biomoléculas
orgánicas u otras.
o
Indispensables: Imprescindibles para la vida de
la célula: Ca, Na, K, Mg, Cl, Fe, I…
o
Variables: No están presentes en todos los
organismos: Br, Zn, Ti…
Bioelementos primarios
-
96’2% de la materia viva
-
CHONPS
-
Favorece enlaces covalentes estables
-
Grupo del carbono y el hidrógeno:
o
El átomo de carbono tiene cuatro electrones en
su última capa y puede formar enlaces covalentes apolares con otros átomos de
carbono o de hidrógeno. Así se constituyen compuestos de carbono: largas cadenas
hidrocarbonadas muy estables.
o
Las moléculas que están formadas únicamente por
C e H son covalentes apolares, insolubles en agua.
o
Las cuatro valencias del átomo de carbono se
disponen hacia los vértices de un hipotético tetraedro.
-
Grupo del oxígeno, nitrógeno, fósforo y azufre
o
Son elementos electronegativos y al establecerse
enlaces covalentes con el hidrógeno o entre sí, dan lugar a moléculas
dipolares.
o
Si a una cadena hidrocarbonada (apolar) se le
añaden suficientes grupos polares puede llegar a tener cierta polaridad y por
tanto, ser soluble en agua.
o
Características:
§
O: Bioelemento primario más electronegativo,
aporta más polaridad y es el más abundante (forma el agua).
§
N: Forma los grupos amino de los aminoácidos y
de las bases nitrogenadas de los ácidos nucleicos.
§
S: Forma el radical sulfhidrilo de muchas
proteínas.
§
P: Constituye grupos fosfato que constituyen el
ATP y para formar los fosfolípidos de las membranas celulares.
Bioelementos secundarios
-
Bioelementos
más abundantes: Se encuentran en una proporción superior al 0’1%.
o
Sodio, potasio y cloro: se
encuentran disueltos en medios internos o en interior de células como iones
Na+, K+ y Cl-. Mantienen el grado de salinidad dentro de las células y el
equilibrio de cargas eléctricas un lado
y otro de la membrana plasmática. Los iones Na+ y K+ son fundamentales en la
transmisión del impulso nervioso.
o
El calcio en forma de carbonato cálcico
forma caparazones y esqueletos, y en forma de ion Ca2+ actúa en reacciones como
la contracción muscular o la coagulación de la sangre.
o
El ion magnesio (Mg2+) es un componente
de muchas enzimas y del pigmento clorofila. También interviene en la síntesis y
degradación del ATP, en la replicación del ADN y en su estabilización y en la
síntesis de ARN.
-
Oligoelementos:
Se encuentran en proporciones inferiores a 0’1%.
o
Hierro: Como ion Fe2+ forma parte de la
composición de la hemoglobina y de la mioglobina (transportadores de moléculas
de oxígeno) y de los citocromos (enzimas que intervienen en la respiración
celular). Su deficiencia causa anemia.
o
Cinc: Abundante en el cerebro, órganos
sexuales y páncreas. Puede formar un complejo con la insulina y mejorar la
solubilidad de esta en las células pancreáticas.
o
Cobre
o
Cobalto: Forma parte de la vitamina B12 y
de algunas enzimas que regulan la fijación del oxígeno.
o
Manganeso: Actúa asociado a diversas
enzimas degradativas de proteínas
o
Litio: Incrementa la secreción de los
neurotransmisores.
o
Silicio: Forma parte de caparazones de
diatomeas y da rigidez a tallos.
o
Yodo: Forma la hormona tiroxina. Su falta
provoca el bocio.
o Flúor: Constituye el
esmalte de los dientes y de los huesos. En los dientes su carencia favorece las
caries.
2- Las Biomoléculas
Algunas biomoléculas forman polímeros llamados macromoléculas
que a su vez están constituidas por monómeros.
Funciones de las biomoléculas
-
Estructural
-
Energética
-
Biocatalizadora
Funciones específicas del O2, CO2 y N2:
-
Oxígeno: interviene en la respiración aerobia.
-
Dióxido de carbono: interviene en la fotosíntesis
de algas y plantas mediante sus cloroplastos.
-
Nitrógeno: gas inerte que solo algunas bacterias
del suelo son capaces de capturarlo y aprovecharlo para sintetizar proteínas.
3- El agua
Sustancia más abundante de la materia viva. En el embrión
humano representa hasta el 94% de su masa y en adultos 63%. Se puede encontrar
en la materia viva de tres formas:
-
Agua
circulante: sangre o savia (en humanos 8%)
-
Agua
intersticial: entre las células (15%)
-
Agua
intracelular: en el citosol o en el interior de los orgánulos celulares
(40%)
En general el agua es obtenida por los organismos del
exterior pero también pueden obtener a partir del agua metabólica formada por otras biomoléculas mediante diferentes
reacciones químicas. EJ:
La molécula de agua
La
molécula de agua presenta un polo negativo, con densidad electrónica alta,
donde está el átomo de oxígeno, y dos polos positivos, donde están los dos
núcleos de hidrógeno, con densidad electrónica baja. Por ello, el agua es una
molécula dipolar. Entre los dipolos se establecen fuerzas de atracción
denominadas puentes de hidrógeno que originan polímeros. Con esto se logra una
masa molecular elevada y el agua se comporta como un líquido. Estas
agrupaciones que duran fracciones de segundo, confieren al agua todas sus
propiedades de fluido.
Propiedades del agua
-
Elevada
fuerza de cohesión entre las moléculas: hace que sea un líquido casi
incompresible proporcionando volumen a las células entre otras cosas.
-
Elevada
fuerza de adhesión: capacidad de adherirse a las paredes de conductos de
pequeño diámetro, ascendiendo en contra de la gravedad (capilaridad).
-
Elevada
tensión superficial: su superficie opone resistencia a romperse, lo que
posibilita que algunos organismos vivan asociados a esta película superficial.
-
Elevado
calor específico: por ello el agua es un buen estabilizador térmico del
organismo frente a los cambios bruscos de temperatura ambiente.
-
Elevado
calor de vaporización: para pasar de estado líquido a gaseoso hace falta
romper todos los enlaces de hidrógeno y para ello se precisa mucha energía.
Esto hace que el agua sea una buena sustancia refrigerante del organismo. El
agua que se evapora en la superficie de un ser vivo absorbe calor del organismo
actuando como regulador térmico.
-
Densidad
más alta en estado líquido que en estado sólido: en estado sólido todos los
enlaces de hidrógeno del agua forman un retículo que ocupa mayor volumen que en
estado líquido y, por tanto, el hielo es menos denso que el agua.
-
Elevada
constante dieléctrica: el agua es un gran disolvente de los compuestos
iónicos, como las sales minerales, y de compuestos covalentes polares, como la
glucosa. El proceso de disolución se debe a que las moléculas de agua se
disponen alrededor de los grupos polares del soluto. En el caso de los
compuestos iónicos sólidos consiguen separar los aniones de los cationes, que
quedan rodeados por moléculas de agua. Este fenómeno se denomina solvatación
o hidratación iónica.
-
Bajo
grado de ionización: de cada 10000000 de moléculas de agua, solo una se
encuentra ionizada:
Funciones del agua en los seres vivos
-
Disolvente:
El agua es un buen disolvente de los compuestos iónicos (sales minerales) y de
los compuestos covalentes polares (glúcidos y proteínas), lo que hace que el
agua sea el medio en el que se realizan casi todas las reacciones biológicas.
-
Reactivo:
El agua interviene en numerosas reacciones químicas (hidrólisis, ruptura
de enlaces con la intervención del agua producida durante la digestión de
alimentos; fotosíntesis, como fuente de hidrógenos).
-
Transportador
-
Estructural:
El agua aporta la forma de la célula por turgencia o plasmólisis.
-
Amortiguador
mecánico: EJ: Líquido sinovial en las articulaciones móviles.
-
Termorregulador:
Debido a su alto calor específico y calor de vaporización.
4- Las sales minerales
Las podemos encontrar en los seres vivos de tres formas:
-
Precipitadas:
Constituyen estructuras sólidas con función esquelética (CaCO3).
-
Disueltas:
Los iones mantienen constante el grado de salinidad dentro del organismo
y constante el grado de acidez (pH).
o
Los aniones más frecuentes son:
o
Los cationes más abundantes son:
EFECTO TAMPÓN: Fenómeno mediante el cual los fluidos biológicos
constituidos básicamente por agua, mantienen constante el grado de acidez pese
a la adición de ácidos o bases.
DISOLUCIONES TAMPÓN O AMORTIGUADORAS: Disoluciones en las que
tiene lugar el efecto tampón.
Los iones del interior celular son
distintos de los del exterior; por eso, a ambos lados de la membrana existe una
diferencia de cargas eléctricas, generándose un potencial eléctrico.
Cada ion ejerce funciones específicas, y en
algunos casos antagónicas.
-
Asociadas
a moléculas orgánicas: Junto a proteínas formando fosfoproteínas o junto a
lípidos formando fosfolípidos. También formando parte de otras moléculas como
la hemoglobina (Fe), la clorofila, los ácidos nucleicos, vitamina B12 (Co)…
5- Las disoluciones y las dispersiones coloidales
Los fluidos presentes en los seres vivos constan de:
-
Fase
dispersante: agua
-
Fase dispersa o soluto: con partículas
o
Disolución:
si el tamaño de las partículas es menor de 5nm. No sedimentan.
o
Dispersión
coloidal: si el tamaño está entre 5nm y 200 nm. Tampoco sedimentan las
partículas.
Propiedades de las disoluciones verdaderas
-
Difusión:
Repartición homogénea de las partículas de un fluido en el seno de otro al
ponerlos en contacto. EJ: Absorción del oxígeno por parte del agua.
-
Ósmosis:
Paso del disolvente a través de una membrana semipermeable desde la disolución
más diluida a la más concentrada hasta que las dos disoluciones alcanzan el
equilibrio (iguales concentraciones).
o
Medio externo isotónico: misma
concentración, célula no deformada.
o
Medio externo hipotónico: célula turgente,
se hincha.
o
Medio externo hipertónico: célula pierde
agua, plasmólisis.
-
Estabilidad
del grado de acidez o pH: si el pH variara, muchas reacciones químicas
cambiarían el sentido de la reacción, y gran parte de las enzimas
precipitarían, lo que podría provocar trastornos graves, incluso la muerte.
Para evitar trastornos del pH intervienen sales minerales disueltas
(disoluciones tampón o disoluciones amortiguadoras) compuestas por un ácido
débil y su base conjugada.
o
Sistema
tampón fosfato
Si en la célula aumentara la acidez (la concentración de iones), la reacción se
desplazaría hacia la izquierda; si disminuyera, la reacción se desplazaría
hacia la derecha. De esta manera se amortiguan las variaciones de acidez.
o
Sistema
tampón bicarbonato
El
ácido carbónico es muy inestable y enseguida se descompone en dióxido de
carbono y agua. Por ejemplo, en una acidosis de sangre, que supone un exceso de
iones H+, el HCO3- se uniría a estos iones y daría ácido carbónico, que se descompondría
en dióxido de carbono y agua.
Propiedades de las dispersiones coloidales
-
Capacidad
de presentarse en forma de gel
o
Forma de
sol: Fase dispersa es un sólido y fase dispersante es un líquido. Tiene
aspecto de líquido.
o
Forma de
gel: Fase dispersa es un líquido y fase dispersante conjunto de fibras
entrelazadas entre las cuales quedan retenidas por capilaridad e hidratación
las moléculas del líquido. Tiene aspecto gelatinoso. (Partículas > agua)
La transformación de sol en gel y viceversa
está en relación con la polimerización y despolimerización de proteínas
fibrilares.
Los geles, al retener el agua, permiten
mantener húmedas estructuras corporales del medio aéreo. Por ejemplo, las
secreciones mucosas de la piel de los caracoles terrestres.
-
Elevado
poder adsorbente: La adsorción es la atracción que ejerce la superficie de
un sólido sobre las moléculas de un fluido. La misma cantidad de una sustancia
ejerce más adsorción si se encuentra finamente dividida ya que presenta más
superficie.
-
Separación
por diálisis
-
Elevada
viscosidad: La viscosidad es la resistencia interna que presenta un líquido
al movimiento relativo de sus moléculas. Las dispersiones coloidales son muy
viscosas porque contienen moléculas o agrupaciones de moléculas muy grandes.
-
Efecto
Tyndall: Debido al pequeño tamaño de las partículas coloidales, las
dispersiones (al igual que las disoluciones verdaderas) pueden ser
transparentes y claras. Pero si se iluminan lateralmente y sobre fondo oscuro,
se observa una cierta opalescencia provocada por la reflexión de los rayos
luminosos.
-
Capacidad
de sedimentación
-
Capacidad
de respuesta a la electroforesis
Técnicas para separar distintos
tipos de biomoléculas
-
Diálisis:
Separación de partículas dispersas según su masa molecular, gracias a una
membrana semipermeable que tan solo deja pasar agua y otras moléculas, pero no
las grandes.
-
Sedimentación:
Las dispersiones coloidales son estables en condiciones normales, pero si se
someten a la acción de la fuerza centrífuga, se puede conseguir que sedimenten
sus partículas.
-
Electroforesis:
Transporte de las partículas coloidales gracias a la acción de un campo
eléctrico a través de un gel. La velocidad es mayor cuando más alta sea su
carga eléctrica global y cuando menor sea su masa molecular. Para realizar una
electroforesis se suelen utilizar geles de almidón o de poliacrilamida.
-
Cromatografía:
Separación de distintas sustancias químicas que se encuentran mezcladas,
tomando como base el diferente grado de retención que sobre ellas ejerce un
medio fijo. Es necesario disolver la mezcla en un fluido y luego hacer pasar
dicho fluido a través de un medio fijo o fase estacional. Si la fase
estacionaria es una superficie sólida se llama cromatografía en capa fina,
y si se trata de una sustancia contenida en una columna, cromatografía en
columna. Las sustancias que son retenidas con menos fuerza avanzan más y
viceversa. Así se consigue separarlas. Cuando el fluido es un gas se llama cromatografía
de gases.
-
Electrofotometría:
Es una técnica de análisis óptico que permite comparar la radiación absorbida
por una solución que contiene una concentración desconocida de soluto con otra
que contiene otra concentración conocida del mismo soluto.
Cada sustancia presenta un grado de absorción
diferente según la longitud de onda utilizada, lo cual permite reconocerla.
Para averiguar la concentración de una sustancia se utiliza la longitud de onda
de la cual presenta la máxima absorbancia. Para realizar esta técnica se
utiliza un espectrofotómetro, aparato que permite variar la longitud de
onda a utilizar y medir la cantidad de radiación no absorbida. Los
espectrofotómetros pueden utilizar radiaciones ultravioletas (180-380
nm), visibles (380-780 nm) e infrarrojas (+780 nm).
 Si cada uno de esos isómeros
espaciales es imagen especular del otro y aunque se giren en el espacio no
coinciden, puesto que son estructuras diferentes se llaman estructuras
enantiomorfas.
Si cada uno de esos isómeros
espaciales es imagen especular del otro y aunque se giren en el espacio no
coinciden, puesto que son estructuras diferentes se llaman estructuras
enantiomorfas.
La presencia de carbonos asimétricos proporciona actividad óptica. Si un rayo de luz polarizada incide en una disolución se produce una desviación de su plano de vibración, y el rayo refractado surge con otro plano de polarización.
o Aldotetrosa:
§
Anómero α: Tiene le grupo –OH del C1 en posición trans, al otro lado del plano
donde está situado el -CH2OHdel C5.
Tema 2: Los glúcidos
1- Características de los glúcidos
-
Constituidos por CH2O.
-
No son carbonos hidratados porque no son átomos
de carbono enlazados con moléculas de agua, sino con grupos alcohólicos (-OH) y
radicales hidrógeno (-H).
-
Siempre tienen grupo carbonilo que puede
ser:
o
Aldehído (-CHO)
o
Cetona (-CO)
-
Clasificación:
o
Monosacáridos: una sola cadena
o
Oligosacáridos: 2-10 monosacáridos (disacáridos)
o
Polisacáridos: +10 monosacáridos
o
Glucolípidos y glucoproteínas
2- Los monosacáridos
-
Terminan en –osa + ceto… o aldo…
o
Triosas
o
Tetrosas
o
Pentosas
o
Hexosas
o
Heptosas
-
Propiedades físicas
o
Color blanco
o
Hidrosolubles: debido a la elevada polaridad
eléctrica de –OH y –H
o
Sabor dulce
-
Propiedades químicas
o
Capacidad de oxidación (perder electrones
ante otras sustancias)
o
Capacidad de aminarse (asociarse a grupos
amino)
o
Capacidad de reaccionar con ácidos e incorporar
grupos fosfato y grupos sulfato
-
Proceso de reducción del reactivo de Fehling
o
Este reactivo es una disolución, de color azul,
de sulfato de cobre en agua:
o
Los iones Cu2+ ganan electrones (se reducen) y forman Cu2O.
o
El cambio de color de azul a rojo revela la
presencia de estos glúcidos.
-
TRIOSAS
o
Los carbonos asimétricos tienen cuatro
enlaces saturados con radicales diferentes.
o
Estereoisómeros: Sustancias con la misma
fórmula empírica y diferente distribución espacial.
o
Cuando el carbono asimétrico más alejado del
grupo aldehído tiene el –OH a la derecha se nombra con D- y a la izquierda L-.
|
La presencia de carbonos asimétricos proporciona actividad óptica. Si un rayo de luz polarizada incide en una disolución se produce una desviación de su plano de vibración, y el rayo refractado surge con otro plano de polarización.
§
Si lo desvían hacia la derecha las moléculas se
denominan dextrógiras y se simbolizan con el signo +.
§
Si lo desvían hacia la izquierda las moléculas
se denominan levógiras y se representan con el signo -.
o
Moléculas epímeras: Dos estructuras que
se diferencian únicamente en la posición de los radicales de UN carbono.
- TETROSAS
- TETROSAS
o Aldotetrosa:
§
Eritrosa
o
Cetotetrosa:
§
Eritrulosa
-
PENTOSAS
o
Cinco átomos de carbono.
o
Aldopentosas:
§
2-Desoxirribosa
o
Cetopentosas
o
En las pentosas la estructura molecular más estable no es la lineal, sino la cíclica: a partir de cinco átomos de carbono
la cadena tiende a ciclarse.
HEXOSAS
HEXOSAS
o
Seis átomos de carbono
o
Al ciclarse pueden formar hexágonos (pirano) como la glucosa o pentágonos (furano) como la fructosa.
o
Enlace hemiacetal: Unión de un aldehído
con un alcohol.
o
El grupo –OH que tiene al ciclarse el carbono 1
se denomina hidroxilo hemiacetálico. Este carbono es ahora asimétrico y se
denomina carbono anomérico.
o
Según la posición de su grupo –OH a un lado u
otro del plano, se distinguen dos nuevas estructuras:
§
Anómero
β: Estos dos radicales
están en posición cis, en el mismo plano.
o
Las
estructuras cíclicas pueden adoptar dos conformaciones en el espacio:
§
Conformación
de nave o bañera
§
Conformación
de silla
o
Aldohexosas:
§
Cuatro carbonos anoméricos (n-2)
§
Hay 16 estructuras moleculares diferentes (16
estereoisómeros): 2^4
§
GLUCOSA: Aporta energía y es muy dextrógira, por
lo que también se le denomina dextrosa.
§
GALACTOSA: Epímero de la glucosa.
§
MANOSA: Epímero de la glucosa.
o
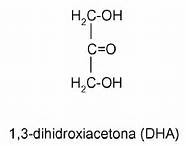
Cetohexosas:
§
Tres carbonos anoméricos (n-3)
§
FRUCTOSA: O D-fructofuranosa. Al ser levógira
también se le denomina levulosa. En el hígado se transforma en glucosa,
por lo que tiene el mismo poder alimenticio que esta.
3- Enlace glucosídico
-
Entre el grupo OH del primer monosacárido y
cualquier OH del segundo monosacárido.
-
Se desprende una molécula de agua.
-
Se nombra α o
β dependiendo de si el primer monosacárido es α o β.
-
Hay dos tipos de enlace O-glucosídico según el
carbono del segundo monosacárido sea o no el carbono carbonilo:
o
Enlace monocarbonílico: Entre el carbono
carbonilíco del primero monosacárido y un carbono no carbonílico del segundo.
El disacárido resultante tiene la capacidad de reducir el reactivo de Fehling.
Para nombrarlos, la terminación del primer monosacárido es –osil y la del
segundo es –osa.
EJ: β-D-+-glucopiranosil (1→4) β-D-+-glucopiranosa.
o
Enlace dicarbonílico: Se establece entre
el carbono carbonílico del primero monosacárido y el carbono carbonílico del
segundo. Al no quedar libre ningún carbono carbonílico, el disacárido
resultante no reduce el reactivo de Fehling. Solo presenta este enlace la
sacarosa: α-D-+-glucopiranosil (1→2)
β-D-frucofuranósido. La terminación del primer monosacárido es –osil y la del
segundo es –osido.
4- Los disacáridos
Unión de dos monoscáridos por un enlace O-glucosídico.
Maltosa: Dos moléculas de D-glucopiranosa unidas por un enlace α (1→4).
Maltosa: Dos moléculas de D-glucopiranosa unidas por un enlace α (1→4).
-
Celobiosa:
Dos moléculas de D-glucopiranosa unidas por un enlace β (1→4).
-
Lactosa:
Molécula de D-galactopiranosa y D-glucopiranosa por enlace β (1→4).
-
Sacarosa:
Molécula de D-glucopiranosa y D-fructofuranosa por enlace α (1→2).
5- Los polisacáridos
HOMOPOLISACÁRIDOS
-
Almidón:
o
Polisacárido de reserva de vegetales
o
Se acumula en forma de gránulos en los plastos.
o
Formado por miles de moléculas de glucosa.
o
Las principales fuentes de almidón son las
semillas de cereales (trigo, maíz y arroz), de las legumbres y de
los tubérculos (patata y boniato).
o
Los gránulos de almidón son insolubles en agua
fría, pero en agua caliente los polímeros más pequeños de almidón se dispersan
en el agua (almidón soluble). La mayor parte continúa en los gránulos (almidón
insoluble).
o
Engrudo de almidón: Pasta pegajosa que se
forma al hincharse los gránulos de almidón insoluble y rodearse de moléculas de
agua.
o
El almidón está formado por dos tipos de
polímeros:
§
Amilosa (30%)
·
Maltosas unidas por enlaces α (1→4)
·
Estructura helicoidal con 6 moléculas de glucosa
·
Con el agua da lugar a dispersiones coloidales
·
Con el yodo se tiñe de azul muy oscuro
·
Por hidrólisis con ácidos o por la acción de la
amilasa da lugar a la dextrina y después a maltosas
§
Amilopectina (70%)
·
Maltosas unidas por enlaces α (1→4)
con ramificaciones en posición α (1→6)
·
Las ramas tienen 12 glucosas unidas por enlaces α (1→4)
·
Presenta únicamente estructura ramificada
·
Poco dispersable en agua
·
Con el yodo se tiñe de azul violáceo
·
Por hidrólisis con ácidos o por la acción de la amilasa
da lugar a moléculas de maltosa y núcleos de ramificación con enlaces α (1→6)
(dextrinas límite, que pueden ser degradadas por la enzima R-desramificante).
-
Glucógeno:
o
Polisacárido de reserva de animales
o
Se halla en el hígado y en los músculos
o
Formado por maltosas unidas por enlaces α (1→4)
con ramificaciones en posición α (1→6) (aprox. 1 ramificación cada 6-10
glucosas)
o
Contiene hasta 15000 maltosas
o
Con el yodo se tiñe de rojo oscuro
o
La encima amilasa actúa sobre el glucógeno dando
maltosas y dextrinas límite. Después mediante maltasas y enzimas
R-desramificantes se obtienen glucosas.
-
Celulosa:
o
Polisacárido con función sostén propio de
vegetales
o
Formado por β-glucosas mediante enlaces β (1→4)
o
Cada pareja de glucosas constituye una celobiosa,
y una celulosa contiene de 150 a 5000 moléculas de celobiosa
o
Estos polímeros forman cadenas moleculares no
ramificadas que se pueden disponer paralelamente uniéndose mediante enlaces de
hidrógeno
o
No es una fuente de energía para los animales
-
Quitina:
o
Componente esencial del exoesqueleto de los
artrópodos (en los crustáceos está impregnada de CaCO3 para aumentar su dureza)
o
Está formado por N-acetil-glucosaminas unidas
por enlaces β (1→4)
o
Forma cadenas paralelas
o
Cada dos moléculas de N-acetil-glucosaminas
forma una quitobiosa
HETEROPOLISACÁRIDOS
Polímeros formados por más de un tipo de monosacárido
distinto.
-
Pectina: En la pared celular de los
vegetales. Tiene una gran capacidad gelificante.
-
Agar: Se extrae de las algas rojas. Al
ser muy hidrófilo se utiliza para preparar medios de cultivo en microbiología.
-
Goma arábiga: Sustancia segregada por las
platas como protector de heridas. Se utiliza en la fabricación de pinturas y
pegamentos.
6- Los glúcidos asociados a otros tipos de moléculas
HETERÓSIDOS
-
Monosacárido + molécula no glucídica
PROTEOGLUCANOS
-
80% polisacáridos + 20% proteína
-
Ácido hialurónico y sulfatos de condoitrina
-
Heparina
PEPTIDOGLUCANOS
-
Cadenas en las que se alternan
N-acetil-glucosaminas y ácido N-acetil-murámico unidas por aminoácidos
GLUCOPROTEÍNAS
-
2-40% glúcidos + proteínas unidos por enlaces
covalentes
-
Mucinas de secreción como las salivares
-
Protrombina
-
Inmunoglobulinas
-
Glucoproteínas de la membrana plasmática
GLUCOLÍPIDOS
-
Monosacáridos + lípidos
-
Cerebrósidos y gangliósidos
7- Las funciones de los glúcidos
o
Glucosa
o
Almidón
o
Glucógeno
-
Estructural: Gracias al enlace
β-glucosídico
o
Celulosa
o
Quitina
o
Peptidoglucanos
o
Condoitrina
o
Ribosa y desoxirribosa
-
Especificidad en la membrana plasmática:
Seleccionan las sustancias que pueden entrar en la célula
o
Glucoproteínas
o
Glucolípidos
-
Otras funciones específicas:
o
Antibiótico (estreptomicina)
o
Vitamina (vitamina C)
o
Anticoagulante (heparina)
o
Hormonal (hormona hipofisaria)
o
Inmunológica (glucoproteínas e inmunoglobulinas)
o
Enzimática (ribonucleasas)
-
Principios activos de plantas medicinales
o
Cardiotónicos (digitalina, se aplica en
enfermedades cardiovasculares)
o
Cianogenéticos (liberan ácido cianhídrico de
efecto mortal)
o
Glicirrina (Efecto expectorante e
antiinflamatorio)
o
Antracénicos (efecto laxante)
















No hay comentarios:
Publicar un comentario